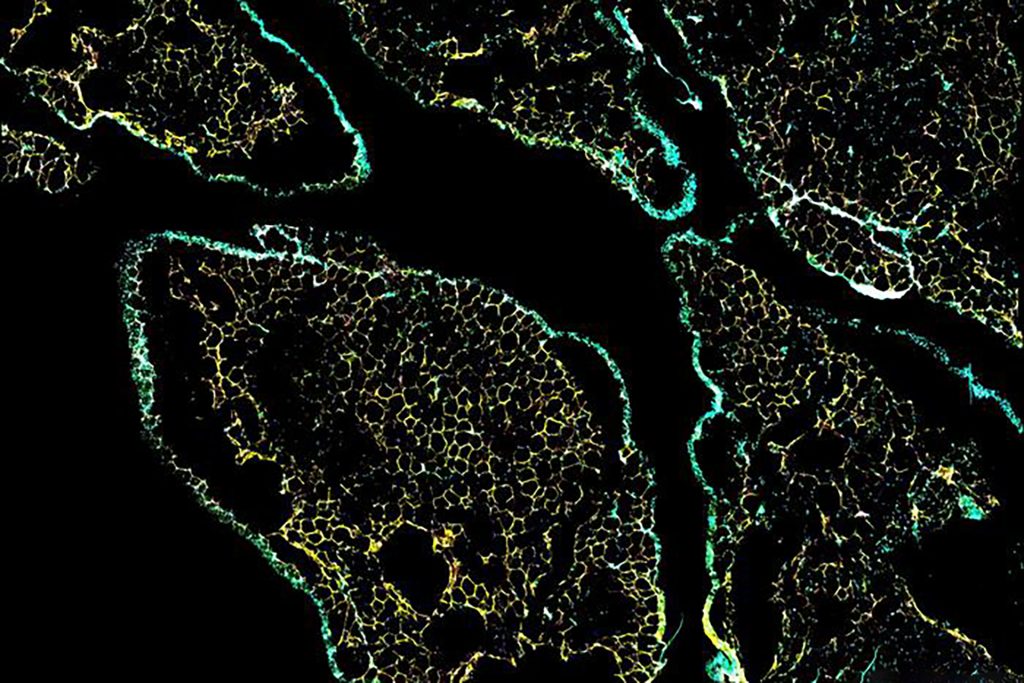
تُعدّ دراسة التفاعلات الكيميائية الحيوية داخل الجسم تحديًا معقدًا، لكن فريقًا بحثيًا أعلن عن تطوير طريقة جديدة لمراقبة هذه التفاعلات بشكل مستمر ودقيق داخل الخلايا الحية، دون الحاجة إلى إتلافها. تعتمد هذه التقنية على الخلايا المعدلة القادرة على تصنيع مكون جديد لرصد نشاط إنزيمات تنظيم البروتين، مما يفتح آفاقًا واسعة لفهم أفضل للعمليات الحيوية وتطوير علاجات جديدة. وتعتبر تقنية الاستشعار الحيوي (biosensing) محور هذا التطور.
هذا النهج الجديد، الذي نُشرت نتائجه في دورية “نيتشر كوميونيكيشنز”، يتجاوز القيود التقليدية التي تتطلب أخذ عينات من الأنسجة أو تفكيك الخلايا للتحليل. بدلًا من ذلك، يسمح للباحثين بمراقبة تعديلات البروتين (protein modifications)، مثل الأستلة (acetylation)، مباشرةً داخل الخلية الحية، وحتى في كائن كامل.
الاستشعار الحيوي: نافذة جديدة على عالم الخلايا
تشبه عملية إنتاج البروتين داخل الخلايا مصنعًا دقيقًا، حيث يتم تجميع الأحماض الأمينية وفقًا للتعليمات الوراثية. لكن البروتينات غالبًا ما تحتاج إلى تعديلات كيميائية إضافية لتصبح ذات وظيفة كاملة، مثل إضافة أو إزالة مجموعات كيميائية دقيقة.
تعتبر الأستلة، وهي إضافة مجموعة الأسيتيل إلى البروتين، أحد أهم هذه التعديلات. تتحكم الأستلة في نشاط البروتينات ووظائفها، وتلعب دورًا حاسمًا في العديد من العمليات الحيوية، بما في ذلك تنظيم الجينات والاستجابة للإشارات الخلوية. إنزيمات الأستلة (acetylation enzymes) هي المسؤولة عن هذه العملية الدقيقة.
تحديات رصد الأستلة
تقليديًا، كان رصد الأستلة يتطلب تحليل عينات من الخلايا أو الأنسجة بعد إتلافها. هذا يعني أن الباحثين كانوا يرون فقط “صورة ثابتة” للعملية، وليس ديناميكيتها وتطورها في الوقت الفعلي. كما أن هذه الطريقة لا تسمح بمراقبة التغييرات المحلية في الأستلة داخل الخلية الواحدة.
النهج الجديد: “الحرف الأميني الـ 21”
للتغلب على هذه القيود، طور فريق البحث بقيادة هان شياو من جامعة رايس نهجًا مبتكرًا يعتمد على إدخال “حرف أميني” إضافي إلى لغة بناء البروتين. هذا الحمض الأميني المعدل، وهو “أسيتيل ليسين”، يتم دمجه في إنزيم متوهج، مما يسمح للباحثين بتتبع نشاط إنزيمات الأستلة بشكل مباشر.
يعمل هذا النظام كحساس دقيق للتغيرات في الأستلة. عندما يمنع الأسيتيل ليسين تفاعل الإنزيم مع المادة المضيئة، يتوقف التوهج. وعندما تتم إزالة مجموعة الأسيتيل بواسطة إنزيمات أخرى، يعود التوهج. بذلك، يصبح الضوء إشارةً مباشرةً لنشاط إنزيمات الأستلة داخل الخلية.
تطبيق عملي ونتائج واعدة
استخدم الباحثون هذا المستشعر الحيوي لاختبار تأثير دواء يثبط إنزيم “إس آي آر تي 1″، وهو إنزيم مهم في إزالة مجموعات الأسيتيل. أظهرت النتائج أن الدواء نجح في تثبيط الإنزيم، لكنه لم يقلل من نمو الورم في نماذج الفئران المصابة بالسرطان.
يشير هان شياو إلى أن هذه النتائج تسلط الضوء على التعقيد الكامن وراء تنظيم الأستلة في الخلايا السرطانية. فقد يكشف هذا النظام أن تثبيط “إس آي آر تي 1” وحده ليس كافيًا لعلاج السرطان، وأن هناك حاجة إلى استراتيجيات علاجية أكثر شمولية تستهدف مسارات متعددة.
بالإضافة إلى ذلك، فإن تطوير هذه التقنية يمثل تقدمًا كبيرًا في مجال اكتشاف الأدوية (drug discovery). فهي توفر أداة قوية لمراقبة تأثير الأدوية على العمليات الحيوية داخل الخلايا الحية، مما يمكن الباحثين من تطوير علاجات أكثر فعالية وأمانًا.
هذه التقنية ليست مقتصرة على تطبيقات السرطان، بل يمكن استخدامها لمراقبة أي عملية حيوية تتضمن تعديلات البروتين، مثل الأمراض العصبية وأمراض القلب والأوعية الدموية.
الخطوة التالية المتوقعة هي توسيع نطاق تطبيق هذا المستشعر الحيوي لدراسة أنواع مختلفة من السرطانات وتحديد الأهداف الدوائية الواعدة. سيحتاج الباحثون أيضًا إلى تحسين حساسية وخصوصية النظام لضمان دقة النتائج. من المتوقع أن تظهر المزيد من النتائج حول هذا التقدم خلال العام المقبل، حيث يشير شياو إلى حاجة المزيد من الدراسات لتأكيد تلك النتائج الأولية.